Öncelikle çözünme olayının nasıl gerçekleştiğini hatırlayalım. İki madde birbiri içerisinde karıştırıldığında madde türlerine bağlı olarak aralarında etkileşimler görülür. Bu etkileşim sonucunda maddelerden biri diğeri içerinde tamamen dağılıyor ise çözünme gerçekleşir. Örneğin NaCl(k) tuzu suya atıldığında Na+ iyonları sudaki oksijen tarafından sarılırken Cl– iyonları da sudaki hidrojenler tarafından sarılır.
Çözünürlük: Sabit sıcaklık ve basınçta 100 g (cm3, mL) suda çözünebilen en fazla madde miktarına çözünürlük denir. Çözünürlük g/100 g su şeklinde gösterilir.
Çözelti: Homojen karışımdır. Şekerli su, alkollü su, doğal gaz çözeltilere örnek verilebilir.
Çözeltilerin Sınıflandırılması
1. Çözünürlüğe Göre Çözelti Türleri
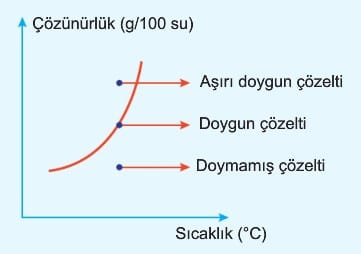
a. Doymamış Çözelti: Belirli sıcaklık ve basınçta bir miktar suyun çözebileceğinden daha az madde çözmüş olduğu çözeltilere denir.
b. Doymuş çözelti: Belirli sıcaklık ve basınçta bir miktar suyun çözebileceği kadar maddeyi çözmüş olduğu çözeltilere denir.
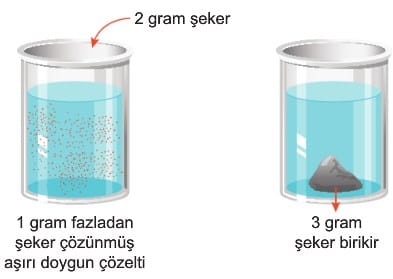
c. Aşırı doymuş çözelti: Öncelikle belirli sıcaklıkta doygun çözelti hazırlanır. Çözünme ısı alarak gerçekleşiyor ise bu çözelti uygun bir şekilde soğutularak çözünen maddenin bir kısmı çökmesi gerekirken çözücü içinde askıda kalır. Ancak bu durum kararsızdır. Yapılan etki ile fazlalık madde dibe çöker ve çözelti doygun hale gelir. Örneğin 1 gram fazla şeker çözünerek hazırlanan çözeltiye 2 gram şeker eklendiğinde kabın dibinde 3 gram şeker oluşur. Dipte biriken şeker eklenen şeker değildir. Eklenen şeker çözünürken çözeltinin alt kısmındaki şeker tanecikleri birleşerek kabın dibine çöker.
Dibinde katısı bulunan çözeltiler doygundur. Aşırı doygun değildir. Bu çözeltilerde çözünme ve çökelme olayları aynı hızla devam etmektedir.
2. çözünen Miktarına Göre Çözelti Türleri
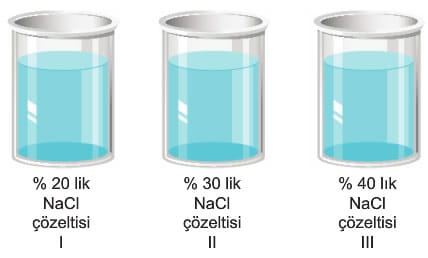
Bu tür çözeltilerde bir çözeltiye bakılarak karar verilmez. Mutlaka aynı maddenin başka bir çözeltisi ile kıyaslanmalıdır. Karşılaştırılan çözeltilerden derişimi az olan diğerine göre seyreltik, derişimi fazla olan da diğerine göre derişiktir. Çözeltilerin seyreltik veya derişik olmasının doygunluk ile ilgisi yoktur. Bir çözelti doygundur ancak farklı bir sıcaklıktaki doymamış bir çözeltiden daha seyreltik olabilir.
3. Elektrik İletkenliğine Göre Çözelti Türleri
Suda çözündüğünde iyonlarına ayrışan veya iyon oluşturan maddelerin sulu çözeltileri elektrik akımını iletir. Bu çözeltilere elektrolit çözelti denir. Çözelti içerisindeki iyon derişimi ve çözeltinin sıcaklığı artıkça elektrik iletkenliği artar. Bu çözeltilerde elektrik iletkenliği iyon hareketi ile sağlanır. Elektrik akımını iletmeyen çözeltilere ise elektrolit olmayan çözelti denir.
Bilgi: Çözeltilerin elektriği iletmesi sırasında kimyasal olay gerçekleşir. Bu tepkimelere elektroliz tepkimesi denir. Bu konuyu 12. sınıf elektrokimya konusunda öğreneceksiniz. Metallerin elektriği iletmesi fizikseldir ve elektrik akımı elektron hareketi ile taşınır.