Aynı veya farklı atomlar arasında elektronların ortaklaşa kullanımı veya elektron alışverişi ile oluşan çekim kuvvetine kimyasal bağ denir. İki atom arasında bağ oluşumu atomların kararlılıklarını artırdığı için dışarıya ısı verir. İki atom arasındaki bağı koparmak için enerji verilmesi gerekir.
İki atom arasındaki bağı kırmak için verilmesi gereken enerjiye bağ enerjisi denir. İki atomun bir araya gelerek bağ oluşturması ile açığa çıkan enerji bağı kırmak için verilmesi gereken enerji ile aynıdır. Bağı koparmak için verilmesi gereken enerji ne kadar fazla ise bağ o kadar sağlam ve kararlıdır.
Br2 molekülündeki bağı koparmak için verilmesi gereken enerji I2 ninkinden fazla olduğu için Br – Br bağı daha sağlam ve kararlıdır. Bağ koparmak endotermik, bağ oluşumu da ekzotermik bir olaydır. Tepkime entalpisi tepkimeyi başlatmak için (ileri aktivasyon enerjisi) verilmesi gereken enerji ile başladıktan sonra dışarıya verdiği (geri aktivasyon enerjisi) enerji arasındaki fark olduğuna göre, tepkime entalpisini,
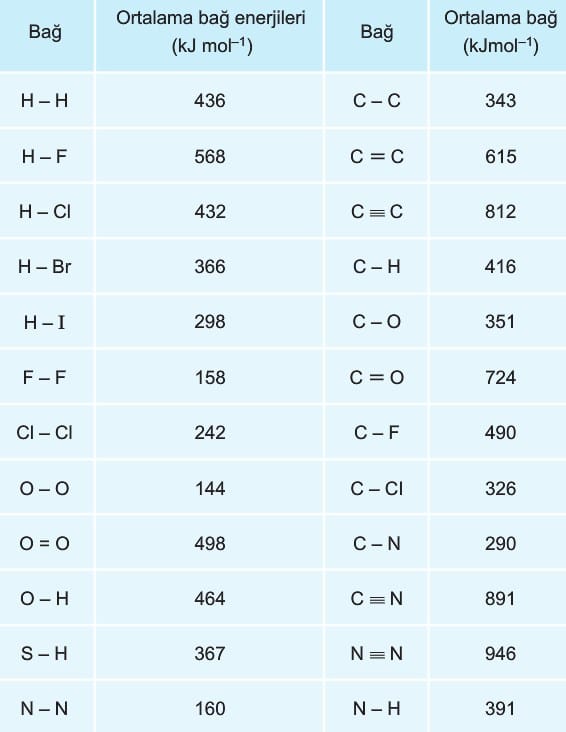
şeklinde hesaplayabiliriz. Bazı elementler arasındaki bağ enerjileri aşağıdaki tabloda verilmiştir.
Bağ Enerjileri ve Tepkime Entalpileri video 11. sınıf Mustafa Yaşar
Bağ Enerjileri ve Tepkime Entalpileri video 11. sınıf Kimya Adası