ISI – SICAKLIK
Maddenin taneciklerden oluştuğunu daha önce öğrenmiştik. Madde katı, sıvı, gaz hallerinden herhangi birinde bulunabilir. Bu üç halde maddenin tanecikleri titreşim halindedir. Bir maddenin sıcaklığı arttığında taneciklerin hızı artar. Madde içindeki tüm tanecikler eşit hızla hareket etmeyebilir. Bir ısıtıcı üzerine yerleştirilmiş kap içindeki sıvının ısıtıcıya yakın bölgedeki tanecikler daha hızlı hareket eder. Bir maddenin taneciklerinin sahip olduğu ortalama kinetik enerjisinin ölçüsüne sıcaklık denir. Sıcaklık, bir enerji türü değildir ancak enerji ile ilgili bir büyüklük ölçüsüdür. Bir maddenin sıcaklığını ölçmek için termometre kullanılır.
Termometre Çeşitleri
Kullanımı amaçlarındaki farklılığa göre termometrelerin yapıları farklıdır. Örneğin kaynayan suyun sıcaklığı alkollü termometreyle ölçülemez. Çünkü kaynayan suda daldırılan alkollü termometre çatlar, dağılır. Bunun nedeni kaynayan suyun 100 °C olan sıcaklığının, alkolün 78 °C olan kaynama sıcaklığından büyük olmasıdır. Oysa kaynayan suyun sıcaklığı cıvalı termometre için bir tehlike değildir. Çünkü cıva 357 °C’ta kaynar, Öte yandan, kutuplarda açık havada yapılan araştırmalar için de cıvalı termometreler kullanılamaz. Çünkü donma noktası -39 °C olduğu için cıva kutuplarda donar. Alkollü termometre ise kutuplarda sorun yaratmaz. Çünkü alkolün donma noktası -112 °C’tur. Görülüyor ki ölçülecek sıcaklığın büyüklüğüne ve ortama göre değişik yapıda termometre kullanmak gerekmektedir. Bu nedenle termometreler şekildeki gibi sınıflandırılabilir.
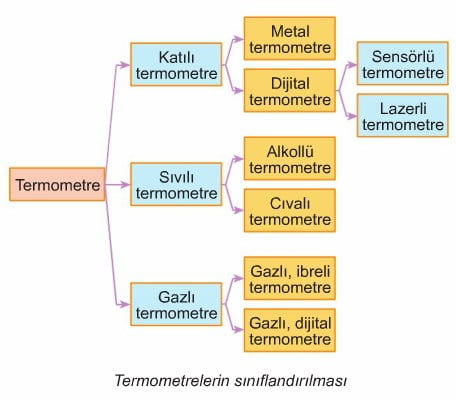
Katılı Termometre

Metal termometre: Metal termometreler, yapılarında sıvı olmadığı için sıvılı termometrelerin elverişli olmadığı yerlerde rahatlıkla kullanılır. Bunlar genellikle yüksek sıcaklıkların (300 °C’tan fazla) ölçülmesi amacıyla kullanılan ölçme araçlarıdır. Yapımlarında temel oluşturan bilgi, bu ünitenin “genleşme” konusunda görülecektir.

Dijital termometre: Dijital termometreler, sıvılı ve metal termometrelerin kullanıldığı her yerde kullanılır. Hem düşük hem de yüksek sıcaklıkları ölçebilen türleri vardır. Yapımlarında sıcaklık algılayıcıları (sensörleri) kullanılır. Sıcaklık algılayıcıları, ısının maddede yarattığı elektriksel olaylara dayanır. Bu olaylara ait bilgiler önümüzdeki yıllarda görülecektir.
Kızılötesi ışınlı (lazerli) termometre: Dijital termometrelerden olup sıcaklığı uzaktan ölçmeye yarayan araçlardır. Hedefe yolladığı kızılötesi ışınların yansımasını algılayarak sıcaklığı ölçer. Yanına yaklaşılamayan ve dokunulmaması gereken cisimlerin sıcaklığını uzaktan ölçmekte kullanılır. Bunlara lazerli termometre de denilmektedir.
Sıvılı Termometreler
Sıvılı termometreler alkollü ve civalı olmak üzere 2 çeşittir. Her iki termometrede sıvıların genleşmesi olayına dayanmaktadır. Sıvıların genleşmesi hakkındaki ayrıntılı bilgileri konu işlenişi sırasında edineceğiz.
Gazlı termometreler

Bu termometreler, ısınan gazın basıncının artması olayına göre çalışır. Metal küre biçimli gaz haznesi, sıcaklığı ölçülecek ortama sokulur. Gazın basınç artışı, sıcaklığa çevrilmiş olarak göstergeden okunur.
Sıcaklık Birimleri
Sıcaklık ölçümünde iki tür termometre kullanılır. Bunlar metal termometre ve sıvılı termometredir. Metal termometreler yüksek sıcaklıkların ölçümünde kullanılır. Çalışma prensibi metallerin sıcaklıkla genleşmesine dayanır. Sıvılı termometreler ise sıvıların genleşmesi prensibine göre çalışır.
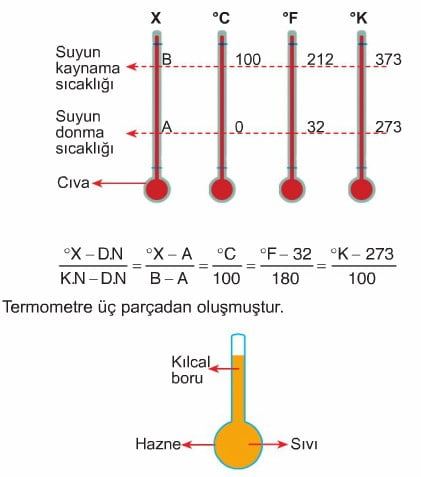
Termometre yapılırken aşağıda belirtilen özelliklere dikkat edilmelidir.
- Haznesi büyük olmalıdır.
- Kılcal borusu ince olmalıdır.
- Kullanılan sıvı, küçük sıcaklık değişimlerinde de genleşebilmelidir (Genleşme kat sayısı büyük).
- Kılcal boru ve haznenin yapıldığı madde, sıcaklık değişimlerinde hemen hemen hiç genleşmemelidir (Genleşme kat sayısı küçük).
Not: Evrende teorik olarak ölçülebilecek en düşük sıcaklık 0 K (-273 °C) dir. Kelvin termometresinin negatif değeri yoktur.
Termometreler Çözümlü Örnekler
İç Enerji
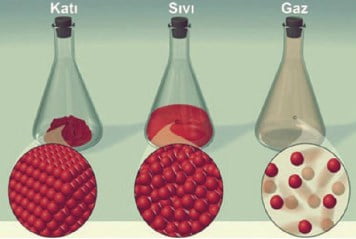
Her maddenin şekildeki gibi atom ya da molekül denilen taneciklerden oluştuğunu biliyoruz. Ayrıca madde taneciklerinin durağan olmayıp daima hareketli olduklarını da öğrenmiştik. Katı maddelerin taneciklerinin sadece titreşim, sıvı madde taneciklerinin titreşim ve ötelenme, gaz madde taneciklerinin de ötelenme ve biraz da dönme hareketi yaptığını bilmekteyiz. Madde taneciklerinin hareketli oluşu onların bir kinetik enerjiye sahip olmaları demektir. Ancak taneciklerin enerjisi sadece kinetik türden değildir. Tanecikleri bir arada tutan yapışma kuvvetleri nedeniyle bir de potansiyel enerjileri vardır. Dolayısıyla maddesel her cisim, içi enerjiyle dolu bir kutu gibidir. Kutuyu dolduran bu enerjide taneciklerin kinetik enerjileri ile tanecikler sisteminin potansiyel enerjisi toplamına eşit bir enerjidir. Bu toplam enerjiye maddenin iç enerjisi ya da ısı enerji denilmektedir.
Isı Enerjisi
Sıcaklıkları farklı iki madde arasında alınan veya verilen enerjiye ısı enerjisi denir. Q sembolü ile gösterilir. Birimi kalori (cal) ya da jouIe(J) dur.
- Maddenin kütlesiyle doğru orantılıdır.
- Sıcaklık değişimi ile doğru orantılıdır.
- Maddenin cinsine bağlıdır.
ve gerekli hesaplamalar
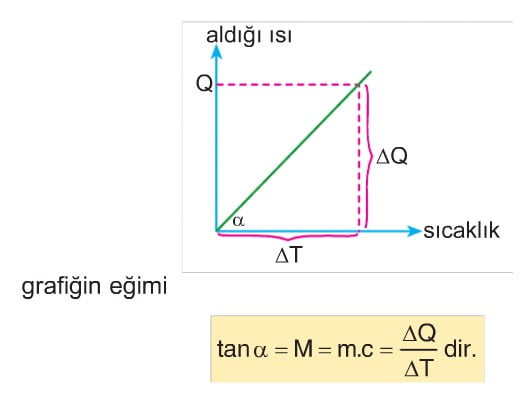
Q = m . c . ΔT
bağıntısı ile yapılabilir.
Öz ısı (c): Bir maddenin 1 gramının sıcaklığını 1°C artırmak için gerekli olan ısı miktarına öz ısı denir. Katı, sıvı ve gazlar için ayırt edici özelliktir. Birimi cal/g°C dir.
Isı sığası (M): Bir maddenin m gramının sıcaklığını 1°C artıran ısı miktarına ısı sığası denir. Birimi cal/°C dir.
M = m.c ile ifade edilir.
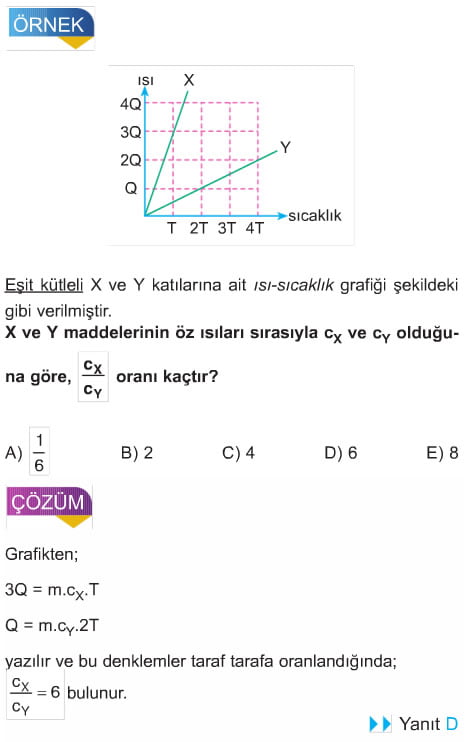
Bir maddenin aldığı ısı enerjisinin sıcaklık değişimine bağlı grafiği şekildeki gibi ise;

Isı Alışverişi
- İki madde arasında ısı alışverişi olabilmesi için sıcaklıkların farklı olması gerekir.
- Isı akışı sıcaklığı büyük olan maddeden sıcaklığı küçük olan maddeye doğru olur.
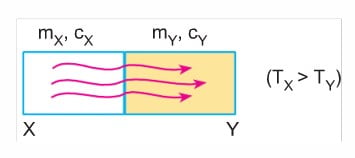
- Hal değişimi olmamak koşuluyla sistem ısıl dengeye geldiğinde denge sıcaklığı, maddelerin ilk sıcaklıkları arasında değer alır.
Tx > Td > TY (Tu : Denge sıcaklığı) - Denge sıcaklığı, ısı sığası büyük olan maddenin sıcaklığına daha yakın olur.
- İki madde arasındaki ısı alışverişi ısıl denge sağlanıncaya kadar devam eder.
- Isıl denge sağlandığında maddelerin ısı değişimleri (AQ) birbirine eşit olur.

Hal Değişimi

Bu olaylarla ilgili aşağıdaki örnekler verilebilir;
* Yağmur veya kar yağarken hava ısınır.
* Soğuk bir günde üşüyen elimize üflersek elimiz ısınır.
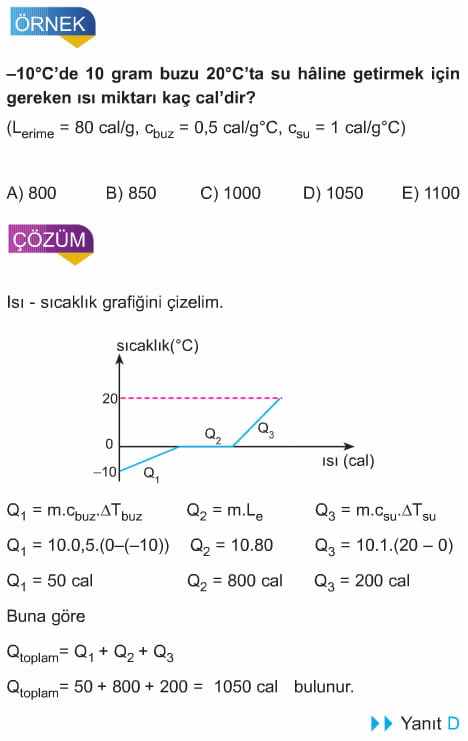
Sabit basınç altında hâl değiştirme sıcaklığında bulunan bir maddenin hâl değiştirmesi için; aldığı veya verdiği ısı miktarı,

Q=mL
formülü ile bulunur. Hâl değiştirme sıcaklığında bulunan 1 gram maddenin hâl değiştirmek için aldığı veya verdiği ısı miktarına hâl değiştirme ısısı (L) denir.
Saf maddeler (elementler, bileşikler) için, sabit basınç altında katı ve sıvı hallerin dengede olduğu sıcaklık derecesine katının erime ya da sıvının donma sıcaklığı (noktası) denir.
Bir sıvının buhar basıncının, sıvı yüzeyine etki eden dış basınca eşit olduğu andaki sıcaklığına kaynama sıcaklığı (noktası) ya da sıvı buharının yoğunlaşma sıcaklığı denir.
Açık hava basıncı bir atmosfer olduğu zaman saf su ağzı açık kapta 100°C de, dış basıncın 10 atmosfer olduğu ortamda ise 180°C`de kaynadığı ölçülmüştür. Düdüklü tencerelerin yemekleri çabuk pişirmesinin nedeni elde edilen yüksek sıcaklıktır.
Bir maddenin,
Erime sıcaklığı = Donma sıcaklığı
Erime ısısı = Donma ısısı
Kaynama sıcaklığı = Yoğunlaşma sıcaklığı
Kaynama ısısı = Yoğunlaşma ısısıdır.
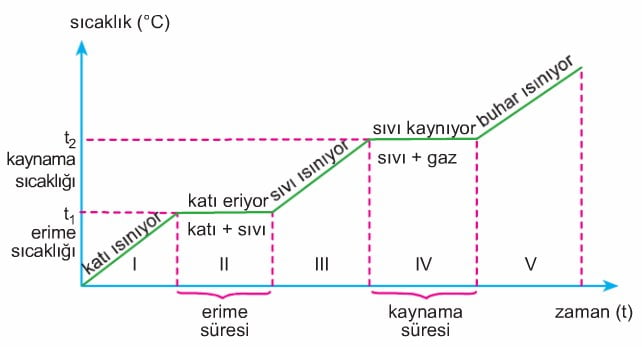
I. Bölge: Madde tamamen katı haldedir, Sıcaklık artışı vardır.
II. Bölge: Madde katı halden sıvı hale geçmektedir. Sıcaklık sabittir.
III. Bölge: Madde tamamen sıvı haldedir.
IV. Bölge: Madde sıvı halden gaz haline geçmektedir. Sıcaklık sabittir.
V. Bölge: Madde tamamen gaz halindedir. Sıcaklık artışı vardır.
Uyarılar:
- Hâl değişimi süresince, hâl değiştiren maddenin sıcaklığı sabit kalır.
- Hâl değiştirme sıcaklığı maddenin cinsine bağlıdır ve ayırt edici bir özelliktir.
- Erirken hacmi küçülen maddelerde (buz, bizmut, antimon) basıncın artması erime sıcaklığını düşürür, Yani
erimeyi kolaylaştırır. Böyle maddelerin katısı, sıvısında yüzen - Erirken hacmi büyüyen maddelerde basıncın artması erime sıcaklığını yükseltir. Yani erimeyi zorlaştırır. Böyle maddelerin katısı, kendi sıvısında batar.
- Basınç arttığında sıvıların kaynama noktaları yükselir. Örneğin; deniz seviyesinde 100°C’de kaynayan su,
dağa çıkıldığında 96,97 ”C’de kaynar. - Maddenin saflık derecesi hâl değişim sıcaklığını etkiler. Örneğin; saf suya tuz karıştırdığımızda suyun kaynama sıcaklığı 100°C’nin üzerine çıkar.
- Buharlaşma hızı;
- Sıvının türüne bağlıdır.
- Sıvının açık yüzeyinin büyüklüğü ile doğru orantılıdır. Çamaşırlar tek kat serilirse daha çabuk kurur.
- Sıcaklıkla doğru orantılıdır.
- Açık hava basıncı ile ters orantılıdır. Basınç arttıkça buharlaşma zorlaşır.
- Hava akımına bağlıdır. Rüzgarlı havalarda Çamaşırlar daha çabuk kurur. Çünkü rüzgar sıvı üzerindeki basıncı
azaltır. Buharlaşmayı artırır. - Sıvının saflık derecesine bağlıdır.

Isının Yayılma Yolları
1. İletim Yoluyla Yayılma: Isıtılan bir maddenin moleküllerinin kazandığı kinetik enerjisini
titreşim yoluyla birinden diğerine aktarması şeklinde gerçekleşen bir yayılma türüdür. Isının iletilmesi moleküllerin titreşimlerini birbirine aktarması şeklinde gerçekleştirdiğine göre ısının iyi iletilmesi için moleküller arasındaki uzaklık çok az olmalıdır. İletim yoluyla yayılma en iyi katılarda, katılar içinde de en iyi metallerdedir. Sonra sırayla sıvıda ve gazdadır. Boşlukta ise iletim yoluyla yayılma olmaz. Durgun hava tabakası da iyi bir ısı yalıtkanıdır.
2. Konveksiyen Yoluyla Yayılma (Taşıma): Isıtılan maddenin moleküllerinin özkütle farkından dolayı birbiriyle yer değiştirmesi şeklinde gerçekleşen yayılma türüdür. Bu yolla yayılma sadece sıvı ve gazlarda olur. Sıvı ve gazlarda bir bölgenin ısınması ile bu bölgedeki maddenin hacmi artar. Hacmi anan maddenin özkütlesi azalır. Özkütlesi azalan madde yukarıya doğru yükselirken bıraktığı boşluğa özkütlesi daha büyük olan madde gelir. Böylece ısı madde içinde taşınmış olur. Denizlerdeki sıcak su akıntıları, sıcak su dolaşım sistemleri, sobanın veya kaloriferin odayı ısıtması konveksiyon yoluyla yayılmaya en güzel örneklerdir.
3. Işıma Yoluyla Yayılma: Isının ışık ışınlarıyla taşınmasıdır. Bir madde üzerine düşen ışınları tutarsa ısınır, yansıtırsa az ısınır. Güneşten Dünyamıza ısı bu yolla ulaşmaktadır. Işıma yoluyla yayılma boşlukta da gerçekleşir. Termosların yapımı ışıma ve iletim yoluyla yayılmaya çok güzel bir örnektir. Termoslar iç içe geçmiş ve arasında durgun hava olan iki kaptan oluşur. Bu durum ısının iletim yoluyla yayılmasını önler. Termosun iç yüzeyi de aynalıdır. Bu da ısının yansıyarak içerde kalmasını sağlar. Yani ışıma yoluyla yayılmasını önler.
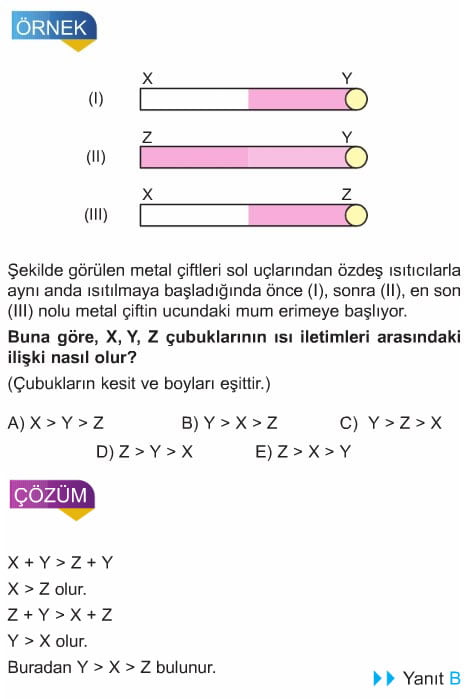
Isı İletim Hızı: Isı aktarımı sadece değişik sıcaklıklardaki bölgeler arasında olur. Isı akışının yönü daima yüksek sıcaklıktan düşük sıcaklığa doğrudur. Bir malzemede ısı iletiminin çabuk ya da yavaş olması enerji iletim hızı kavramı ile ifade edilir. Enerji iletim hızı sıcaklık farkına, ısı iletiminde kullanılan malzemenin kesitine ve uzunluğuna göre değişir. İki nokta arasındaki sıcaklık farkı ne kadar fazla olursa enerji iletim hızı da aynı oranda fazla olur. Yani enerji hızı bölgeler arasındaki sıcaklık farkı ile doğru orantılıdır.
Uçları arasındaki sıcaklık farkı Dt olan cisimde enerji iletim hızı, uçları arasındaki sıcaklık farkı 2Dt olan cisimdeki enerji iletimi hızının yarısına eşit olur. Yani sıcaklık farkı 2 kat artırılırsa enerji iletim hızı da iki kat artar. Isı iletiminde kullanılan malzemenin kesiti (A) artırılırsa enerji iletim hızı artar. malzemenin boyu ( L) artırılırsa enerji iletim hızı azalır. Buna göre enerji iletim hızı malzemenin kesiti ile doğru orantılı, boyu ile ters orantılıdır.
Kesiti A olan cisimdeki enerji iletim hızı, eşit boyda ve kesiti 2A olan cisimdeki iletim hızının yarısına eşit olur. Yani cismin kesiti 2 kat artırılırsa enerji iletim hızı da 2 kat artar. Boyu L olan cisimdeki enerji iletim hızı, kesiti aynı ve boyu 2L olan cisimdeki enerji İletim hızının 2 katı olur. Yani cismin boyu 2 kal artırılırsa enerji iletim hızı 2 kal azalır.









Yazan kral nerede ya çok iyiymiş bu